>>Omicron : le risque d'hospitalisation réduit jusqu'à 70%, selon l'Agence sanitaire britannique
>>États-Unis : autorisation d'une pilule anti-COVID et ruée sur les tests
 |
| La pilule molnupiravir contre le COVID-19 développée par Merck, en mai, avant son autorisation. |
| Photo : AFP/VNA/CVN |
"L'autorisation d'aujourd'hui ajoute un nouveau traitement contre le COVID-19, sous la forme d'une pilule qui peut se prendre oralement", a expliqué une responsable de la FDA, Patrizia Cavazzoni.
Bien que la vaccination reste l'outil principal dans la lutte contre la pandémie, les experts se félicitent de l'arrivée de nouveaux traitements oraux qui devraient, à terme, être facilement accessibles en pharmacie, sur présentation d'une ordonnance.
Les traitements de Pfizer et Merck étendent "l'arsenal des traitements disponibles", ce qui peut réduire la pression sur le système de santé du pays, a ajouté Patrizia Cavazzoni.
Les traitements anti-COVID jusque-là disponibles, comme les anticorps monoclonaux ou le remdesivir de Gilead, sont administrés par intraveineuse.
Le médicalement développé par Merck, laboratoire connu sous le nom de MSD en dehors des États-Unis et du Canada, pourra être pris dans les cinq jours qui suivent l'apparition des symptômes, et réduit le risque d'hospitalisation et de décès de 30% parmi la population fragile, selon des essais cliniques réalisés sur 1.400 participants.
Mercredi 22 décembre, la FDA a autorisé le traitement de Pfizer, commercialisé sous le nom de Paxlovid, qui réduit ce même risque de 90%, selon des essais cliniques, et soulève moins d'inquiétudes quant aux effets secondaires.
Résistance aux variants
Les médicaments de Pfizer et de Merck, qui ne visent pas la protéine Spike du virus, en constante mutation, devraient être plus résistants aux nouveaux variants comme Omicron. D'après les deux entreprises, les résultats préliminaires en laboratoire soutiennent cette hypothèse.
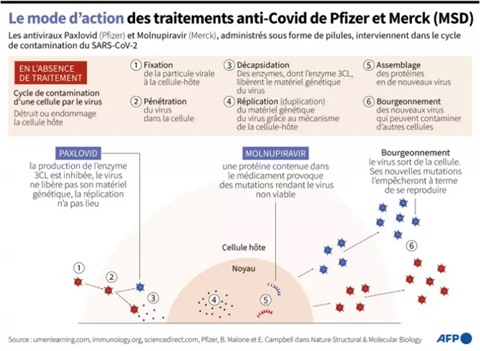 |
| Description des effets des traitements contre le COVID-19 de Pfizer et Merck (MSD) sur le cycle de contamination du SARS-CoV-2. |
| Photo : AFP/VNA/CVN |
La pilule de Pfizer consiste en une combinaison de deux pilules prise deux fois par jour pendant cinq jours. Cette pilule pourra être administrée aux patients à haut risque âgés de 12 ans et plus.
Le traitement de Merck, nommé molnupiravir, s'administre lui avec huit doses par jour pendant cinq jours. Il a déjà été autorisé au Royaume-Uni et au Danemark.
Il fonctionne en s'introduisant dans le génome du virus pour provoquer des mutations qui limitent sa reproduction.
Dans son document d'autorisation, la FDA souligne que la pilule de Merck ne doit être administrée que si d'autres options ne sont pas disponibles ou pas recommandées.
La pilule Pfizer, par exemple, se marie mal avec certains traitements et n'est pas recommandée pour les patients avec des graves insuffisances rénales ou du foie.
Si les essais cliniques n'ont pas détecté de risques majeurs pour les patients pour les deux médicaments, celui de Merck suscite davantage d'inquiétudes.
L'Agence américaine du médicament n'a pas autorisé la pilule de Merck pour les moins de 18 ans car elle pourrait toucher le développement osseux et des cartilages.
Elle n'est pas non plus recommandée pour les femmes enceintes, en raison de risques potentiels pour le foetus, mais les médecins peuvent passer outre si les avantages l'emportent sur les risques.
Des résultats préliminaires, qui ne prenaient en compte qu'une partie des participants à l'essai, avaient d'abord avancé une réduction de 50% du taux d'hospitalisation et de décès chez les patients à risque, un chiffre finalement ramené à 30% sur les résultats complets.
Les États-Unis ont acheté 3,1 millions de traitements Merck et 10 millions de celui de Pfizer. Merck a annoncé auprès de l'AFP pouvoir en livrer "des centaines de milliers" dans les prochains jours et trois millions d'ici fin janvier.
Le pays fait face, à l'avant-veille de Noël, à l'avancée rapide du variant Omicron, désormais majoritaire aux États-Unis.
AFP/VNA/CVN